[과학자의 연구실] 암유발 인자 ‘PLK1’을 목표로 한 표적항암제 개발
2021.04.16 09:00 한국기초과학지원연구원(KBSI)
의약화학분야 국제학술지 Journal of Medicinal Chemistry誌 표지논문 선정
“암입니다.”
의사의 말 한마디에 나락으로 떨어졌던 환자들은 그 당시의 절망적인 순간을 ‘사형선고’에 빗대어 설명하기도 합니다. ‘암’은 곧 ‘죽음’이라는 인식이 팽배하기 때문인데요.
완치가 힘들고 치료 과정이 고통스럽다는 점 외에도 ‘한국인 사망원인 1위’라는 타이틀은 그 인식을 더욱더 확고하게 만들고 있습니다. 암을 정복하기 위한 연구진들의 불철주야 연구가 과학과 의학의 역사에 고스란히 드러나는 점도 이를 방증하죠.
그러나 최근 상황이 달라지고 있는데요. 연구진들의 노력이 과학기술의 진보에 힘입어 빛을 발하고 있는 겁니다. 암세포만 골라 죽일 수 있는 세상이 곧 올 수 있다는 희망 섞인 이야기도 결코 뜬구름 잡는 이야기로 치부되진 않을 것 같은데요. KBSI가 공동연구팀과 개발한 표적항암제가 주목받고 있는 이유 역시 여기에 있습니다.
진단과 치료를 동시에…신개념 표적항암제 개발
급속도로 증식하는 암세포는 완전 사멸이 힘들고, 전이하는 특징도 있어 치료가 굉장히 어렵습니다. 이러한 이유로 외과적인 수술 외에 효과가 탁월한 항암제 역시 중요할 수밖에 없는데요.
KBSI 바이오융합연구부 방정규, 유은경 박사 연구팀이 한국생명공학연구원, 한국과학기술연구원, 미국 국립암연구소(NCI/NIH) 등과의 국제공동연구를 통해 개발한 표적항암제는 기존 항암제가 건강한 세포까지 공격해 부작용이 컸던 것과 달리 암을 유발하는 단백질만을 타겟 하여 부작용을 최소화해 눈길을 끌고 있습니다.
이를 이용해 암을 초기에 진단할 수 있는 진단제로서의 역할을 동시에 수행할 수 있다는 것도 강점으로 꼽히고 있죠.
그렇다면 일단 표적항암제에 대해 알아볼까요?
표적항암제란 특정 단백질이나 유전자 변화를 타겟으로 삼아 공격하는 약물을 말합니다. 암의 성장과 발생에 관여하는 두 단백질의 상호작용을 저해해 암세포가 생존할 수 없도록 하는데요. 암세포만 골라서 죽일 수 있기 때문에 부작용이 적고 그만큼 효과도 좋겠죠.
그러나 두 단백질의 상호작용 부위를 정확히 규명하는 것은 무척이나 어려운 일인데요. 모래사장에서 바늘 찾기, 서울에서 김 서방 찾기보다 힘들다는 게 방정규 박사의 설명입니다. 그 이유는 두 단백질의 결합 부위가 뚜렷하게 나타나는 경우가 드물기 때문입니다.
여기에 더해 결합 부위의 깊이도 얕아 그 부위를 정확하게 규명하는 것은 난제로 여겨지고 있습니다.

KBSI 바이오융합연구부 방정규 박사 ⓒKBSI
“천신만고 끝에 결합 부위를 찾아냈어도, 그 부위를 타겟으로 한 약물을 합성하는 것은 더 어려운 일인데요. 항암제로 인한 부작용이 바로 정확하지 않은 약물 설계에서 오는 결과라고 생각하시면 될 것 같아요. 현재 알려진 인산화 단백질은 총 518개인데 모두 다른 기능을 갖고 있어 원하는 인산화 단백질만 저해하는 것은 참으로 어려운 도전이라고 할 수 있습니다.”
그 어려운 일을 공동연구팀이 성공한 것인데요. 연구팀은 암 유발과 밀접한 관련이 있는 폴로유사인산화효소(polo-like kinase 1, 이하 PLK1)의 폴로 박스 도메인(polo box domain)을 타겟으로 약물을 설계했고, 이 약물이 정확하게 두 단백질의 결합 부위만을 공격하는 것을 확인할 수 있었습니다.
PLK1과 폴로박스 도메인
PLK1은 세포의 유사분열 과정에서 중요한 역할을 하는 효소입니다. 폐암, 흑색종 등 다양한 종의 암세포에서 발현이 증가하는 것으로 관찰되는데, PLK1이 과발현하면 비정상적인 중심체가 증폭되고 이로 인해 세포의 부적절한 분리가 발생해 종양을 형성하게 되죠. 연구팀이 주목한 것도 바로 이 부분이었습니다.
“대부분의 암세포에서는 PLK1이 과발현 되어 있다는 것이 잘 알려져 있었습니다. 실제로 암세포에서 과발현된 PLK1의 발현량을 정상세포 수준으로 낮추니 암세포가 더이상 생존하지 않았습니다. 즉 암세포가 PLK1에 중독되어 있다는 것을 알았죠.”
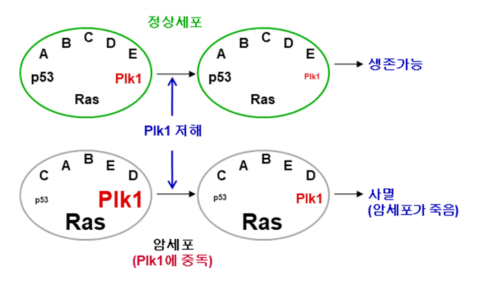
Plk1 과 암세포의 상관 관계 ⓒKBSI
그러나 PLK1에서도 어느 부분을 타겟으로 해야 할지가 문제였습니다. 1998년 미국국립암연구소의 이경상 박사가 PLK1의 밑단(C-말단)에 위치한 폴로박스 도메인이 약물의 타겟이 될 수 있다는 것을 규명해 냈지만, 그중에서도 어느 부분을 타겟으로 해야 하는지에 대해서는 연구가 많이 필요한 상태였습니다.
이에 방정규 박사 연구팀은 이경상 박사 연구팀과 함께 2009년 방사광 가속기를 이용해 폴로박스 도메인에서도 두 단백질이 상호작용하는 핫스팟을 발굴하는 데 성공했는데요. 또한, 단백질의 3차원 구조를 정확히 규명해 네이처 자매지에 게재하기도 했습니다. 방 박사는 PLK1 관련 항암제 개발의 패러다임이 바뀌었다고 설명했습니다.
“논문이 출간된 이후 해당 연구 분야에 많은 변화가 있었습니다. 기존에는 단백질 N-말단의 카이나아제 도메인을 타겟으로 한 약물 개발에 주력해 왔는데, 이 논문이 출간되면서 폴로박스 도메인을 타겟으로 한 약물 개발이 활발해졌습니다. 폴로박스 도메인은 PLK1에만 존재하기 때문에 다른 단백질 효소와 차별화됩니다. 부작용을 최소화할 수 있다는 것이죠. 그렇기 때문에 폴로박스 도메인의 발견은 부작용 적은 약물 개발의 ‘핵심’이라고 할 수 있습니다.”

PLK1 구조 ⓒKBSI
경구 투약 가능한 항암제로 개발
난관은 또 있었습니다. 항암제의 경우 세포막 통과가 필수인데 반해, 펩타이드 기반 약물은 세포 투과성이 현저히 떨어진다는 게 문제였습니다. 방정규 박사는 문제 해결을 위해 저분자 화합물 약물 개발에 돌입했는데요.
“방사광 가속기를 이용해서 기존에 획득한 3차원 구조를 기반으로 저분자 화합물 약물을 설계하기로 했습니다. 세포 투과가 가능해 주사제로 개발되는 일반적인 항암제와 달리 이번 연구에서 개발된 항암제는 경구투약이 가능하다는 장점을 갖고 있습니다.”
공동연구팀은 개발한 항암제를 암에 걸린 실험 동물에 투여한 결과, 암 억제 효과를 확인했으며, 항암제를 형광 물질과 함께 주입한 결과 정확하게 암 부위만을 타겟으로 하는 것을 확인함으로써 초기 암진단도 가능함을 증명했습니다. 방 박사는 이번 연구결과가 향후 진행될 연구개발에 적용될 수 있다는 점을 강조했는데요.

3차원 구조를 기반으로 한 경구투약 가능한 저분자 화합물 설계 ⓒKBSI
“이번 연구결과는 암 유발 단백질의 특정 결합 부위를 타겟으로 하는 항암제 개발에 따라 항암제를 암세포에 정확히 전달하는 것이 가능해졌다는 데 있습니다. 이로써 암세포 주변 다른 세포까지 파괴하는 항암제의 부작용 문제를 해결함과 동시에, 신규 암 바이오마커 개발에도 적용할 수 있을 것으로 예상합니다.”
이번 연구성과는 의약화학분야 저명 국제 학술지인 Journal of Medicinal Chemistry(논문명 : Development of a Polo Like Kinase1 Polo-Box Domain Inhibitor as a Tumor Growth Suppressor in Mice Model; 공동교신저자 : 이경상(미국 국립암연구소), 유은경(KBSI 바이오융합연구부), 방정규(KBSI 바이오융합연구부), IF=6.205, JCR 상위5%이내)에 12월 10일 표지논문으로 게재됐습니다.
10년간 한 우물 판 의지의 결과
이 연구는 2010년부터 시작됐습니다. 연구에만 10년이란 시간이 걸린 셈인데요. 공동연구팀은 10년간 한가지 목표 달성을 위해 함께 달려온 전우였습니다. 방정규 박사는 공동연구가 아니었으면 난제를 풀지 못했을 것이라고 강조했는데요.

방정규 박사 연구실 ⓒKBSI
“연구에서 가장 어려웠던 것은 저희가 발굴한 약물이 폴로박스 도메인의 어느 부위에 정확히 결합하는지를 밝히는 부분이었습니다. 이 질문에 대한 답은 방사광 가속기를 이용한 3차원 복합구조 규명에 있었는데, 3년간 매달렸지만 결국 실패했어요. 다음 2년도 실패의 연속이었던 시기였습니다. 구조를 풀기 위한 시간만 5년이 걸린 셈이죠. 그래도 각각의 연구팀이 제 역할을 했기에 견딜 수 있었던 것 같아요.
먼저 저희 팀에서 약물을 설계하고 합성하면 미국국립암연구소 이경상 박사팀에서 활성이 있는지, 그리고 그 활성이 어느 정도인지를 실험해 주셨습니다. 이러한 피드백을 반복하여 가장 활성이 좋은 약물 후보 물질을 발굴한 후 유은경 박사 연구팀에서 약물의 작용기작을 비롯하여 약물 타겟 및 효능을 검증했습니다. 최근의 학문은 융복합이 되어야만 좋은 결과를 얻을 수 있습니다. 그런 면에서 볼 때 현재의 연구는 공동 연구가 최선의 답이 아닐까 생각하고 있습니다.”
방 박사는 이제 첫걸음을 뗐다고 표현하기도 했는데요.
“신약 개발을 위해서는 보통 10~20년 걸린다고 하는데 이제 저희는 첫걸음을 시작했다고 보면 됩니다. 약물의 독성 실험 및 임상실험까지는 갈 길이 너무 멀어요. 또한, 비용도 많이 들겠지요. 이번 약물 이름이 KBJK557입니다. K는 KBSI에서 왔으며 BJK는 제 이름 이니셜이고 557은 557번째 화합물에서 나온 약물이라는 뜻입니다. 제가 정년까지 10년 남았으니 그 안에 제 이름으로 된 신약이 하나 나온다면 더할 나위 없을 것 같습니다.”
* 이 글은 한국기초과학지원연구원(KBSI) 네이버 블로그로부터 제공받았습니다.

KBSI의 다른 콘텐츠 ↓
‘암세포’만 골라 죽일 수 있는 세상, 곧 온다
관련기사
Previous
노벨생리의학상, 면역 연구로 암치료 혁신
암 성장 부추기는 ‘숨겨진 유전자’ 발견
“등수놀이 위험, 호기심 키워야”
기초과학과 특허에 대한 단상
암(癌) 최전방 공격수 ‘NK세포’, 이동경로 밝혀졌다
“암세포 아킬레스건 찾았다”
“중·일 대응, 화학기술로 선도해야”
쓸모없어 보이는 연구라도 계속해야 하는 이유
‘암세포’만 골라 죽일 수 있는 세상, 곧 온다
‘암세포’만 골라 죽일 수 있는 세상, 곧 온다
'창조하신 대로 사는 생활 지식 > 하나님 백성의 건강 관리' 카테고리의 다른 글
| 코로나19 감염자 생사 가르는 2가지 요인 '나이' '기저질환' (0) | 2021.04.18 |
|---|---|
| 심장이 이유 없이 '쿵쾅쿵쾅' 뛰는 심방세동, 예측인자 남녀 다르다 (0) | 2021.04.18 |
| 최악의 통증.. 췌장암의 가장 중요한 증상은? (0) | 2021.04.17 |
| 자주 먹으면 장을 망치는 인기 음식들 (0) | 2021.04.17 |
| AI로 암과 치매의 비밀을 푼다 (0) | 2021.04.14 |