https://www.joongang.co.kr/article/25204808
밥 이렇게 먹으면 덜 늙는다, 내 수명 늘리는 ‘확실한 방법’ | 중앙일보
새로운 노화 메커니즘이 우리에게 알려주는 사실은 뭘까.
www.joongang.co.kr
- 카드 발행 일시2023.11.06
🎥 이번 영상에서 다룬 내용
우리는 왜 늙는 걸까. 지금까지 많은 과학자들은 노화의 근본 원인이 DNA 어딘가에 숨어 있을 거라 짐작해 왔다. 생명 활동은 DNA 설계를 따르기 때문이다. 하지만 최첨단 생명과학은 DNA 설계보다 이를 ‘이행하는 메커니즘’에 주목하고 있다. 이런 메커니즘 중 하나가 ‘후성유전체’이고, 또 다른 하나는 ‘RNA’다.
후성유전체에 대해선 본 시리즈가 소개한 적이 있다(☞ 50대가 20대 피부 돌아갔다, 세계 흥분시킨 ‘안티에이징’). 후성유전체를 활용한 대표적인 노화 지연 방식이 ‘야마나카 인자(Yamanaka factors)’다. 야마나카 인자는 세포 시계를 거꾸로 돌려 노화 세포를 젊은 시절로 되돌린다.
최근 독일 쾰른대 연구팀은 RNA에 주목했다. DNA 정보는 RNA를 거쳐 인체에서 실질적 기능을 수행하는 단백질을 만들어낸다. DNA 정보가 RNA에 옮겨지는 과정을 전사(轉寫·transcription)라고 한다. 연구팀은 전사의 빠르기 변화가 노화를 일으키는 핵심 원인임을 밝혀냈다. 전사 속도가 빨라지면 정확도가 떨어진다. 세포에 손상이 축적되고 불량 단백질이 만들어진다. 따라서 노화가 진행된다.
연구팀은 노화 지연 방법에 대해서도 실험을 통해 증명해냈다. RNA 전사 속도를 느리게 만들어주는 방법이다. 장수하는 노인을 보면서 경험적으론 느끼고 있었지만, 배후의 원리는 정확히 알지 못했던 것들이다.
새로운 노화 메커니즘이 우리에게 알려주는 사실은 뭘까. 그리고 RNA 전사 속력을 늦추는 노화 지연 기술은 어떤 것일까.
① 새롭게 밝혀낸 노화 메커니즘
② RNA에 무슨 일이 벌어지나
③ 수명 늘리는 생활 습관도 RNA 속력 때문
④ 속속 드러나는 노화 원인
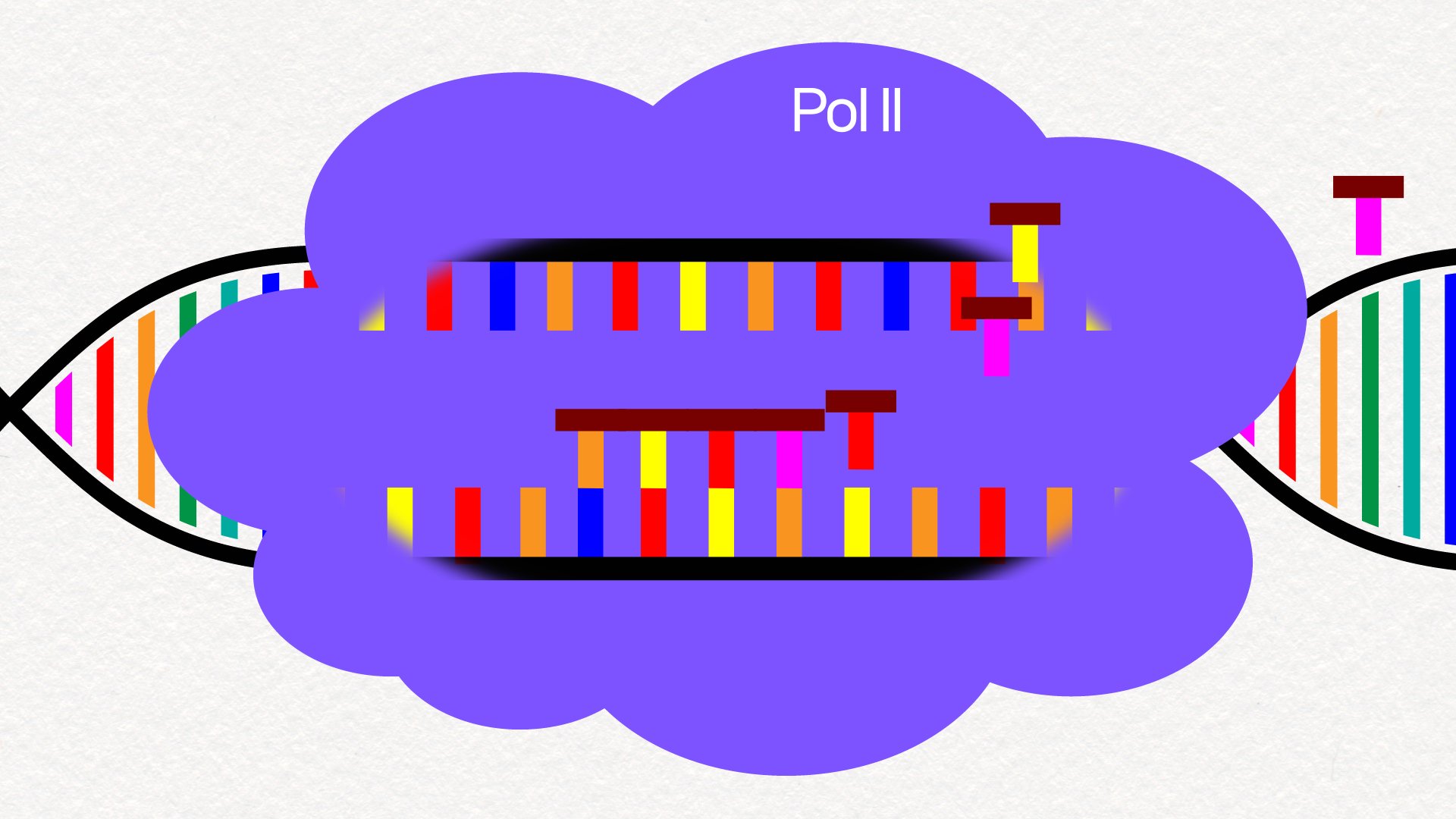
노화의 원인은 뭘까. 그 주된 이유 중 하나가 최근 밝혀졌다. DNA가 아닌 RNA를 전사하는 ‘생체 기계’인 Pol II의 속력 변화다. DNA 정보를 RNA에 전달해주는 효소인 Pol II는 나이가 들면서 속력이 점점 빨라지면서 정보를 누락하거나 오류를 만든다. 그래픽 이가진·박지은
※아래 텍스트는 영상 스크립트입니다.
👴새롭게 밝혀낸 노화 메커니즘
“노화에 기여하는 새로운 메커니즘을 발견했을 수도 있습니다.
이것은 매우 놀라운 일이라고 생각합니다.
이런 일은 매일 일어나는 일이 아니니까요.”
(안드레아스 바이에르 독일 쾰른대 유전학 교수)
노화의 새로운 메커니즘을 발견했다는 이 사람은 독일 쾰른대 안드레아스 바이에르 교수입니다.
노화의 비밀을 풀기 위해 다른 연구자들이 하지 않는 접근법을 취했죠.
바이에르 교수는 “Pol II의 속도 변화가 노화에 아주 결정적인 영향을 미친다”며 “얼마나 빨리 노화하는지뿐 아니라 수명에도 영향을 준다”고 했다.
그 결과 그와 연구팀은 인간을 포함해 다섯 가지 종류의 동물에게서 공통적인 노화의 근본 원인을 찾아냈습니다.
DNA 정보가 RNA로 전사될 때의 빠르기가 문제였습니다.
이 속력이 빨라지면 오류가 많아집니다.
불량품 단백질이 만들어지고 세포가 손상되죠.
DNA 정보를 RNA로 찍어내듯 복사하는 건 Pol II라는 효소다. 복사 속도에 따라 정확도가 달라진다. 이는 노화의 결정적 변수가 된다. 그래픽 이가진·박지은
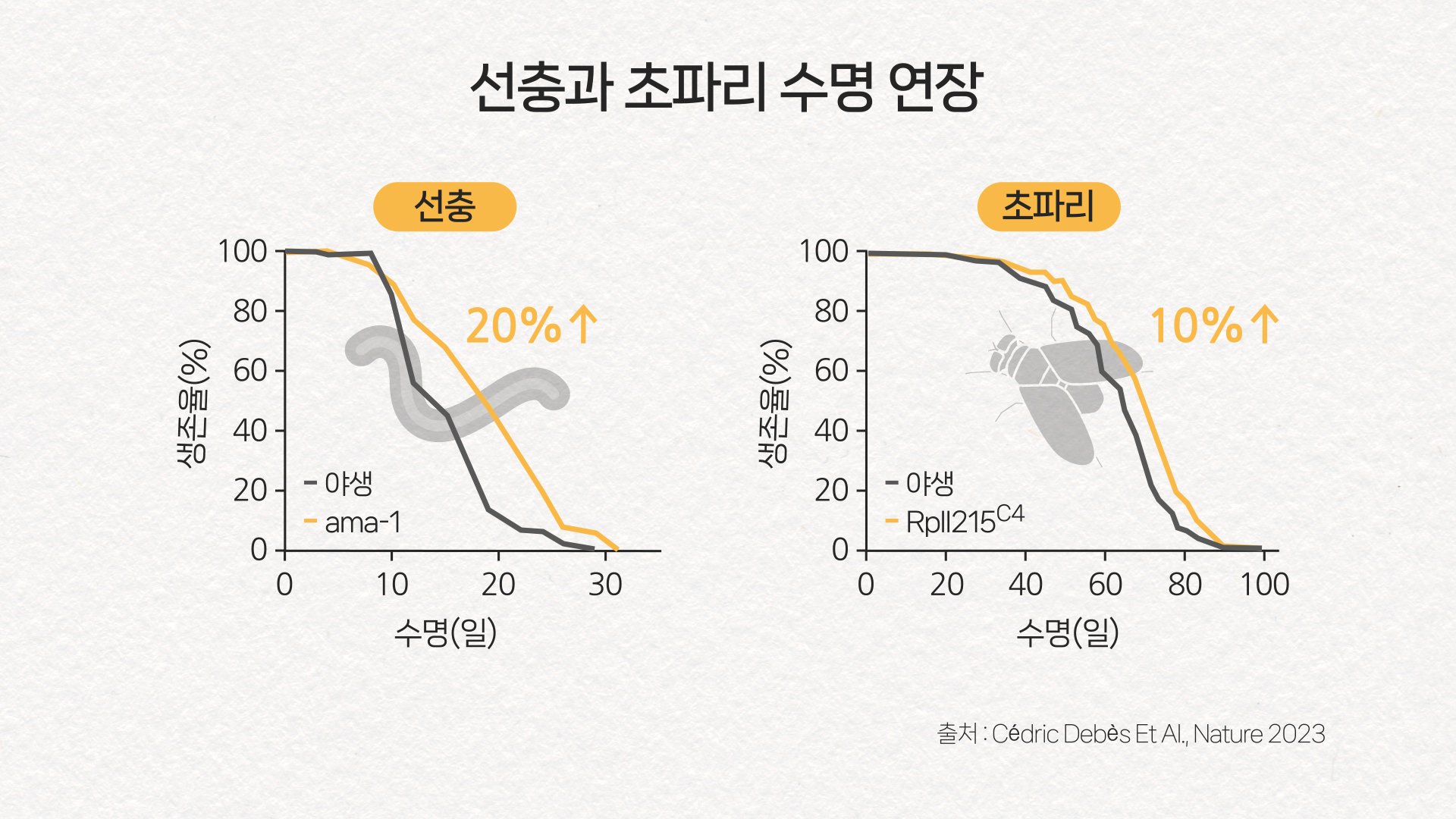
그래서 이 속력을 줄이는 조치를 해보니 선충과 초파리의 수명이 늘어났습니다.
이런 조치 중엔 우리가 실생활에서 따라 할 수 있는 것도 있습니다.
식이 제한과 인슐린/IGF의 신호를 감소시키는 것입니다.
식이 제한은 말 그대로 섭취 열량을 줄이는 것이고요.
인슐린과 IGF의 신호를 감소시킨다는 건 몸에서 인슐린이나 IGF가 덜 나오게 하는 건데요.
간단한 생활 습관 변화가 Pol II에 영향을 미쳐 노화 속도에 차이를 일으킬 수 있다. 그래픽 이가진·박지은
보통 당이나 탄수화물 섭취를 줄이거나 간헐적 단식을 하면 됩니다.
규칙적 운동과 충분한 수면, 적정 체중을 유지하는 것도 도움이 되죠.
지금까지 대부분의 노화 연구자들은 유전자에 주목해 왔습니다.
그런데 해답은 유전자보다 이 유전자를 작동하는 시스템에 있었습니다
“몇 년 전 이 프로젝트를 시작했을 때만 해도 노화 분야 대부분의 연구자는 주로 어떤 유전자가 발현되고 아닌지에 집중하고 있었습니다.
불과 최근 12개월 동안 밝혀진 건 다양한 과정에 의해 전사와 RNA 생성, 단백질 생성이 나이가 들면서 정확도가 떨어진다는 사실입니다.
이것이야말로 이 논문만의 독특한 관점이라고 생각합니다.”
(안드레아스 바이에르 독일 쾰른대 유전학 교수)
언뜻 보면 복잡해보이는 이번 연구의 의미는 무엇인지, 그리고 식이 제한은 어느 정도까지를 말하는 건지 연구자와의 인터뷰를 통해 알아보겠습니다.
🧬RNA에 무슨 일이 벌어지나
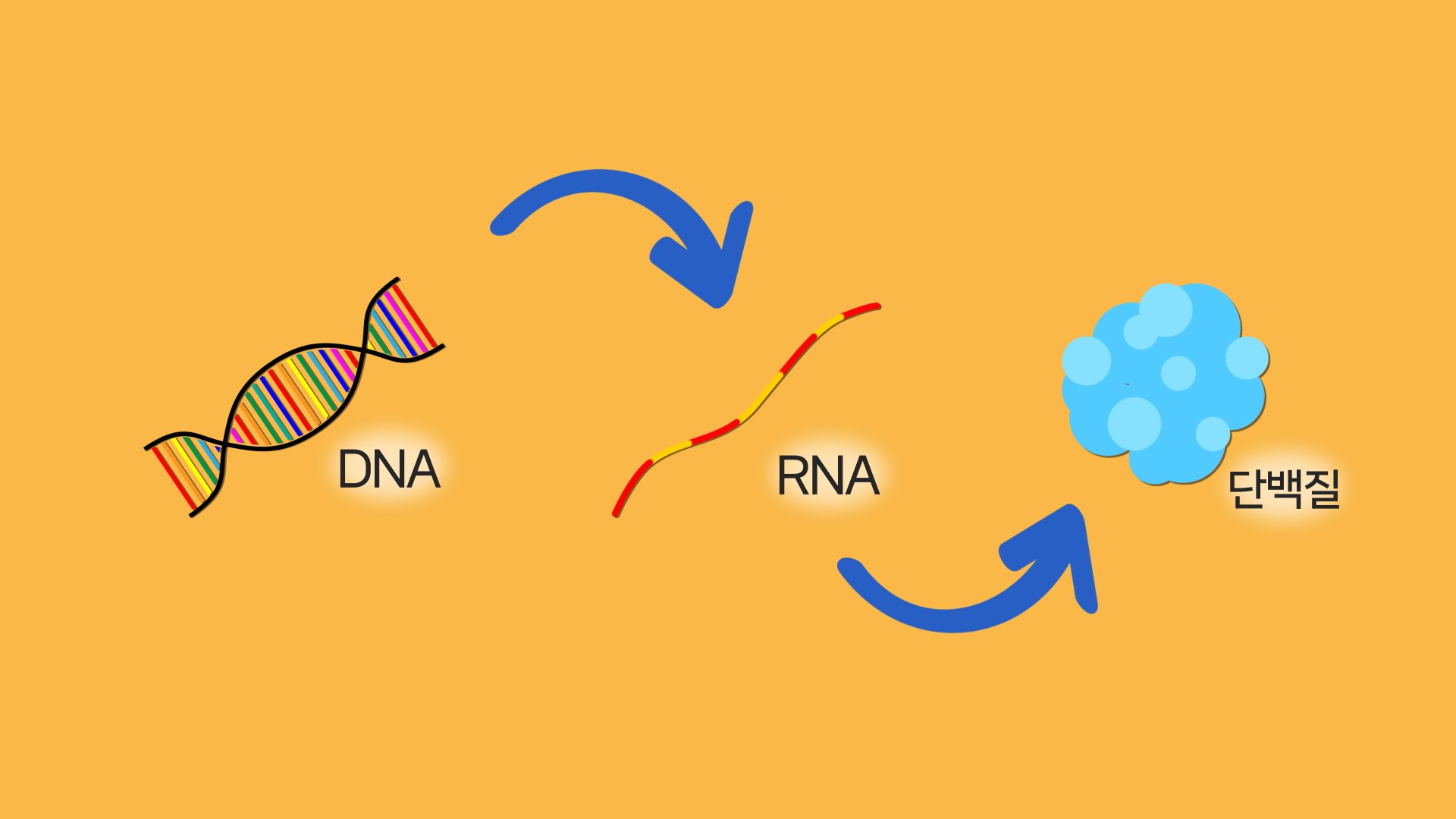
우선 이번 연구 결과를 이해하려면 일단 DNA와 RNA, 그리고 단백질이라는 게 어떤 건지, 서로 어떤 관계를 맺고 있는지는 대충 알아야 됩니다.
DNA 정보는 RNA로 옮겨지고, 그 정보로 RNA가 단백질을 만든다. 단백질은 우리 몸 속 현장에서 작동하는 일꾼이다. 그래픽 이가진·박지은
자, 짧게 설명드리자면 우리 몸엔 세포마다 DNA가 들어 있습니다.
이건 우리 몸을 어떻게 만들고 작동하게 하는지 적혀 있는 구체적인 설명서죠.
근데 이게 다 암호로 돼 있어 읽고 이해하고 실행하는 존재가 필요하게 되죠.
그게 RNA입니다.
DNA 정보가 RNA로 옮겨지면 RNA가 특정 장소로 이동해 단백질을 만듭니다.
단백질은 일꾼입니다.
DNA의 정보를 우리 몸에서 실제로 이행하는 현장 노동자죠.

우리 몸에 있는 다양한 종류의 단백질이 수행하는 기능. 이 단백질은 모두 DNA 설계에 따라 RNA를 통해 제작된다. 그래픽 이가진·박지은
우리 몸을 기업이라고 치면 DNA는 판을 짜는 CEO고, RNA는 지시를 내리는 관리자고, 단백질은 현장에서 일하는 실무자라고 볼 수 있습니다.
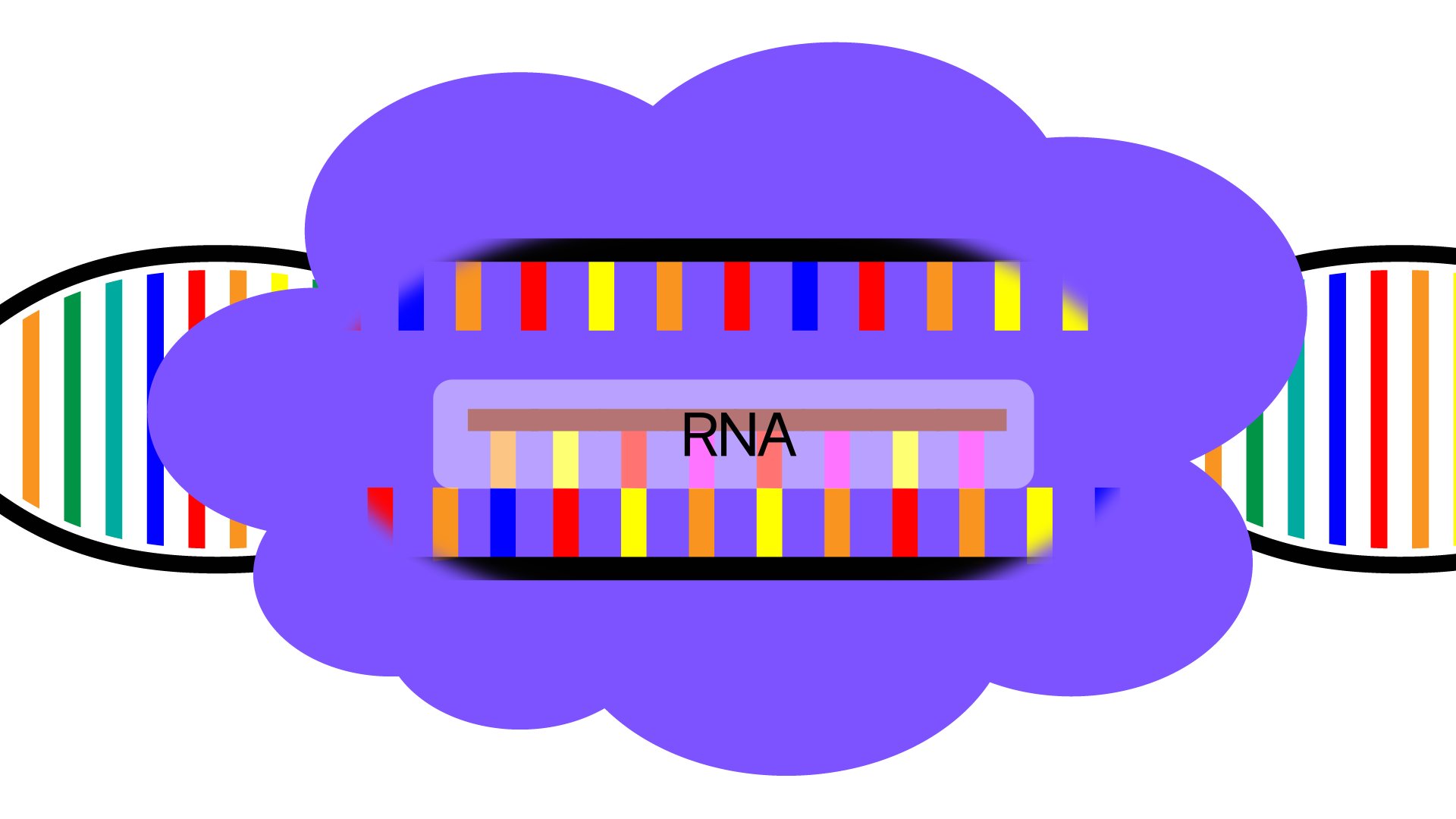
그런데 DNA 정보가 RNA로 옮겨지는 과정을 전사라고 합니다.
DNA 정보가 RNA로 전사될 때 개입하는 효소가 Pol II입니다.
Pol II가 DNA 가닥을 훑고 가면서 DNA 정보를 쭉 복사하는 기계와 같죠.
이 정보로 나중에 단백질을 합성해냅니다.
RNA 정보에 따라 단백질이 만들어지므로 DNA 정보를 정확하고 꼼꼼하게 전사하는 게 매우 중요하다. 그래픽 이가진·박지은
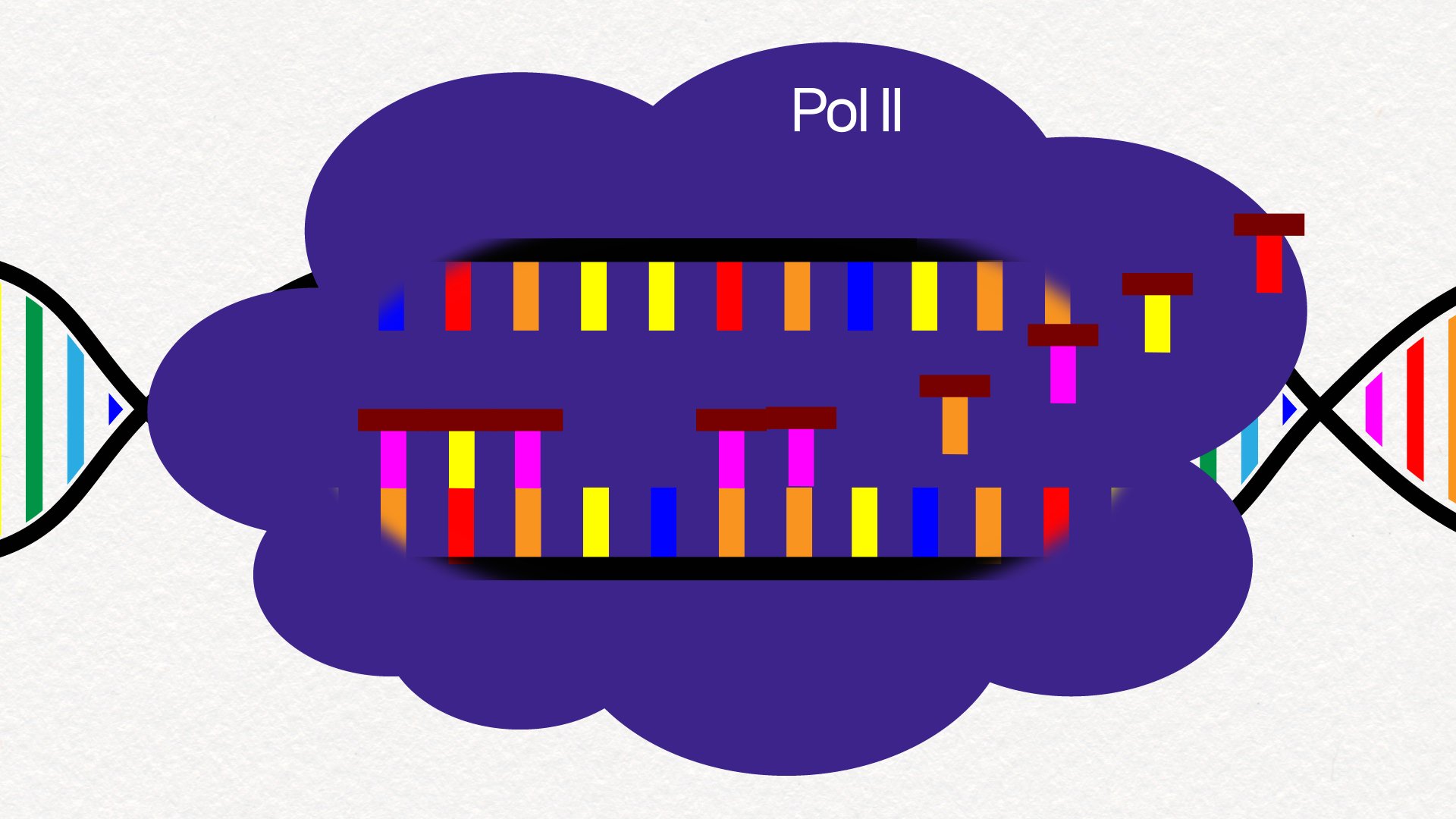
그런데 꼼꼼하게 일을 수행하려면 너무 빠르면 안 되겠죠.
하지만 나이가 들면 Pol II의 속력이 점점 빨라집니다.
오류가 많이 생기고 세포가 손상되죠.
이런 현상은 인간뿐 아니라 다른 동물에서도 관찰됩니다.
서두르면 일을 그르친다. RNA의 전사도 마찬가지다. 그래픽 이가진·박지은
“우리가 알아낸 건 전사되는 속력이 나이가 들면서 빨라진다는 겁니다.
이는 노화 정도와 수명에 영향을 미칩니다.”
(안드레아스 바이에르 독일 쾰른대 유전학 교수)
“제가 이번 연구가 특별하다고 강조하고 싶은 건 여러 종에서 (Pol II의) 속력 증가를 관찰했다는 겁니다.
선충, 초파리, 생쥐, 들쥐, 인간이죠.”
(애덤 앤티비 독일 막스플랑크연구소 노화생물학 교수)
앤티비 교수는 “Pol II라는 생체 기계는 매우 복잡해 아직은 손대기가 쉽지 않다”며 “대신 운동이나 식이 요법 등을 통해 영향을 미칠 수 있다고 본다”고 말했다.
노화의 근본적인 원인 중 하나가 규명된 셈입니다.
다양한 동물들이 모두 같은 이유로 늙어갑니다.
Pol II가 전사할 때의 속력 변화죠.
💨수명 늘리는 생활 습관도 RNA 속력 때문
그렇다면 Pol II의 빠르기 변화는 노화의 결과일까요, 원인일까요.
이쯤에서 그런 의문이 들죠?
그래서 연구팀은 Pol II 속력이 느려지게 유전자 조작을 한 동물이 실제로 노화도 덜 되는지를 알아봤습니다.
그 결과 실제로 선충과 초파리의 수명이 각각 20%, 10% 늘었습니다.
그저 상관 관계가 아닌, 인과 관계를 갖고 있음을 보였죠.
Pol II의 속력을 느리게 하자 실제로 수명이 연장됐다. 그래픽 이가진·박지은
“우리 연구는 (Pol II의 속력 변화가) 노화에 영향을 미친다는 걸 분명히 보였습니다.
두 동물 종에서 Pol II의 속력을 감소시켜봤고, 그게 벌레와 파리의 수명을 연장시켰습니다.
이를 통해 속력 증가가 노화에 인과적으로 기여한다는 결론을 내렸습니다.
그것도 아주 결정적인 방식으로 변화를 일으킵니다.
결정적인 영향을 미칩니다.”
(안드레아스 바이에르 독일 쾰른대 유전학 교수)
그리고 어떤 조치를 하면 Pol II의 속력 증가를 막을 수 있는지도 보였습니다.
지금 알려져 있는 수많은 수명 연장 생활 습관 중에 식이 제한과 인슐린/IGF 신호 제한을 택했습니다.
이 방법이 과학적으로 가장 확실한 방법이기 때문이죠.
“식이 제한은 수명을 연장하는 여러 시도 중 아주 제대로 구축된 방법입니다.
이미 수 년, 아니 수십 년 동안 연구됐습니다.
그 메커니즘을 우리는 이미 잘 이해하고 있기 때문에 쓰기 적절했죠.”
(안드레아스 바이에르 독일 쾰른대 유전학 교수)
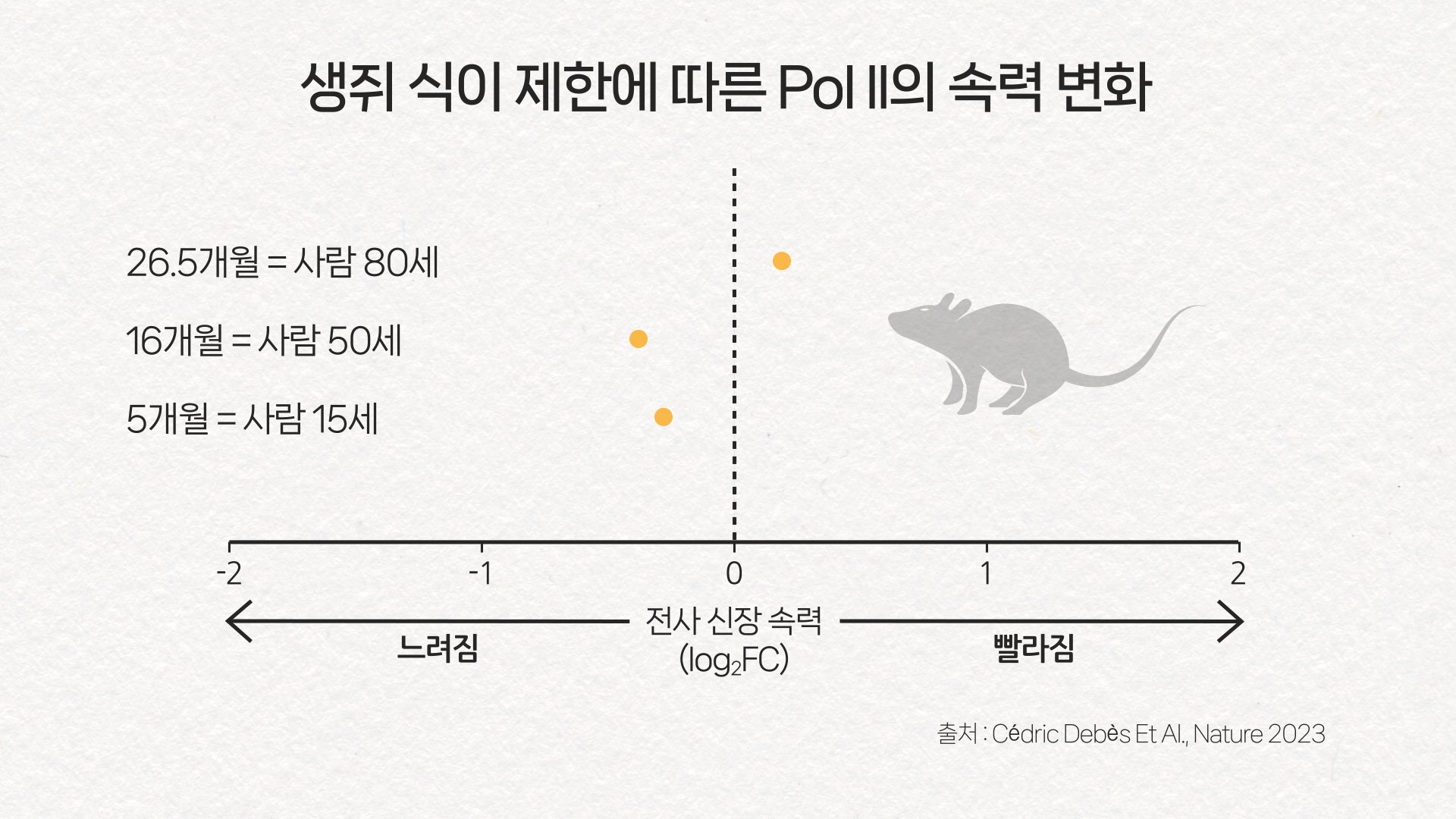
소식하는 쥐는 Pol II의 속력이 느려졌다. 다만 너무 고령의 쥐에게선 그 속력이 오히려 빨라지기도 했다. 그래프 이가진·박지은
연구팀은 생쥐에게 4주 동안 평소 섭취량의 70% 음식만 먹였습니다.
그러자 마음껏 음식을 먹은 생쥐에 비해 Pol II의 속력이 느려졌습니다.
다만 너무 나이 든 쥐에게 적용하자 역효과가 나타났습니다.
이 일련의 실험으로 삼단 논법에 의해 인과 관계가 증명됐습니다.
먹을 걸 덜 주거나 인슐린 신호를 제한하면 Pol II가 느려지고, Pol II가 느려지면 노화가 늦춰진다는 사실이죠.
소식하면 덜 늙고 오래 사는 게 왜 그런지 메커니즘이 밝혀졌죠.
“우리의 접근 방식에서 독특한 점은 Pol II 속력과 수명 사이의 인과관계를 확립한 것이라고 생각합니다.
Pol II에 아주 작은 돌연변이를 일으켰죠.
그래서 첫번째는 수명을 연장하고 둘째로는 속도를 늦춘다는 걸 보였습니다.
상관관계가 아닌 인과관계를 규명한 것이야말로 우리 논문을 돋보이게 하는 것이라고 생각합니다.”
(애덤 앤티비 독일 막스플랑크연구소 노화생물학 교수)
💥속속 드러나는 노화 원인
이번 연구를 수행한 독일 쾰른대는 노화 연구 분야의 세계 최정상급 기관입니다.
특히 DNA 수준의 노화 연구에서 매우 높은 평가를 받고 있죠.
쾰른대엔 CECAD라는 연구소가 있는데요.
여기엔 그냥 쾰른대 교수만 소속된 게 아니고요.
세계적 연구소나 다른 대학교 교수들도 참여해 함께 연구합니다.
독일 쾰른대 CECAD 연구소는 세계적인 권위의 노화 연구기관이다. ‘Cluster of Excellence on Cellular stress responses in Aging-associated Diseases’의 약자로 ‘노화 관련 질병의 세포 스트레스 반응에 관한 우수 클러스터’란 뜻이다. 독일에선 전문성이 매우 높은 기관에 대해 정부가 우수 클러스터로 지정해 전폭적으로 지원한다. 우수 클러스터엔 해당 대학 연구자뿐 아니라 다른 기관 연구자들도 들어와 함께 연구한다. 2022년 현재 총 57개 연구기관이 우수 클러스터로 지정돼 있다. 노화 관련한 우수 클러스터는 쾰른대가 유일하다. 사진 독일 쾰른대 CECAD
이번 연구는 지난 4월에 나왔고, 나오자마자 학계와 일반인에게 엄청난 반응을 얻었습니다.
상위 1%의 관심을 모았죠.
이번 연구는 노화의 근본 원인 중 하나를 규명했다는 점에서 큰 관심을 모았다. 사진 독일 쾰른대 CECAD
쾰른대에선 지난 3월에도 굉장한 연구를 낸 적이 있습니다.
나이가 들면서 왜 우리 몸이 점점 DNA 손상을 복구하지 못하는지 메커니즘을 밝혀냈습니다.
DREAM이라는 다양한 단백질이 결합한 복합체가 범인이었습니다.
DREAM이 손상된 DNA 복구를 방해했죠.
DREAM 복합체는 여러 단백질의 복합체다. 인체에서 다양한 역할을 수행한다. 연구팀은 DREAM을 억제하는 ‘하르민’이라는 물질을 사용했다. 그러자 DNA 손상이 줄었다. 그래픽 이가진·박지은
또 4월에는 쾰른대의 다른 연구팀이 추위에 노출됐을 때 왜 수명이 느는지를 밝혔습니다.
지금까지 체온을 낮추는 것이 수명을 늘려주는 매우 효과적인 방법인 건 알려져 있었습니다.
다만 왜 그런지는 확실치 않았죠.
하지만 쾰른대 연구팀이 프로테아좀이 활성화돼 노화 단백질을 분해하기 때문이란 걸 밝혔습니다.
프로테아좀은 몸 안에서 단백질 분해와 재활용을 담당하는 아주 큰 분자다. 추위를 만나면 프로테아좀이 활성화하고 노화 관련 단백질을 더 잘 분해한다. 그래픽 이가진·박지은. 사진 독일 쾰른대 CECAD
올해만 해도 노화가 DNA 단위에서 어떻게 일어나는지 그 메커니즘을 파헤친 연구가 연달아 나오고 있습니다.
노화가 우리 몸의 아주 작은 단위에서부터 어떤 식으로 작동하는지 점점 깨닫고 있다는 뜻입니다.
그리고 이를 억제하는 방법도 함께 시도하고 있습니다.
정말 노화의 지연이 가까워지고 있는 걸까요.
놀라운 동시에 문득 두렵습니다.
관련기사
불로장생의 꿈: 바이오 혁명
인간이 건강을 결정하는 시대입니다. 기술이 질병을 통제하는 시대입니다. 세상엔 수만 가지 치료법과 신약이 떠돕니다. 하지만 믿을 만한 정보는 한정적입니다. 영상 시리즈 〈불로장생의 꿈 : 바이오혁명〉은 세계적 권위의 전문가 인터뷰를 토대로 세상을 선도하는 신약과 최신 치료법에 대해 가장 앞선 이야기를 전합니다. 새로운 치료법과 신약을 기다리시는 분, 바이오테크의 미래가 궁금하신 분, 생명과학의 놀라운 발전을 쉽게 이해하고 싶으신 분에게 도움이 되고자 합니다.
에디터
-
우리가 사는 세상을 바꿔놓을 파괴적 아이디어를 탐구합니다
-
중앙일보 정수경입니다.
-
중앙일보 영상부 이가진입니다.
'창조하신 대로 사는 생활 지식 > 하나님 백성의 건강 관리' 카테고리의 다른 글
| 쌍둥이 대상 실험했더니… 채식 vs 잡식, 심장에 더 좋은 건? (0) | 2023.12.04 |
|---|---|
| 전신 혈액 돌게 하는 '이 부위'… 안 풀어주면 피떡 생기기도 (2) | 2023.11.24 |
| ‘만병의 근원’ 몸속 냉기…온기 보충하는 음식은? (0) | 2023.11.16 |
| 국내 의료진이 만든 로봇으로 ‘심장 스텐트 시술’ 첫 성공 (0) | 2023.11.16 |
| 담도암 사망률 세계 1위 한국…특히 이 하천의 민물고기 위험 (0) | 2023.11.12 |