[Focus] 한국과총 ・ 2021. 7. 24. 9:00

흑사병이 지나간 유럽에서 르네상스, 종교개혁, 뉴턴의 물리학이라는 새로운 세상이 열렸다면 코로나19가 지나간 21세기 지구에는 어떤 새로운 세상이 펼쳐질까? 팬데믹이 지속된 지난 1년 반 동안 IT 기술을 이용한 온라인 세상이 일상의 한 부분이 되었다. 그리고 또 다른 한편에서는 코로나19 바이러스를 진단, 치료, 예방하는 생명과학 기술의 혁명적인 발전이 이루어졌다. 특히 mRNA 백신을 전 세계 식약처의 허가를 받아서 이용하게 된 것은 주목할 만한 BT 혁명의 시작이다. mRNA를 살아있는 동물에 주입하여 세포 스스로 외부의 단백질을 생산하도록 하는 방법은 1990년 처음 시작되었으며 지난 30년간 눈부신 성장을 이룩하여 왔다. 지금까지 mRNA를 이용한 항암치료제, 독감 백신, 지카 바이러스 백신 등이 개발됐지만 미 식품의약국(FDA) 허가를 받은 의약품은 코로나19 mRNA 백신이 처음이다.
mRNA 플랫폼 기술
mRNA 백신의 가장 큰 장점은 플랫폼 기술이라는 것이다. 지금까지 의약품을 개발할 때는 유기 합성법 또는 단백질 제조법으로 신약을 개발한 후에 이에 맞는 새로운 약물 전달 방법도 개발해야 했고 또한 그 독성도 확인해야 했는데, 이 과정에서 오랜 시간과 큰 비용이 필요했다. 신약의 화학적 성질이 매번 달라서 모든 작업을 다시 해야만 하는 어려움도 있었다. 그런데 mRNA는 원래 체내에 상당히 많이 있는 분자이고 쉽게 분해되는 특성이 있어서 독성이 거의 없다. 그리고 mRNA를 이용한 의약품은 화학적 성질이 거의 같아서 한번 mRNA를 세포에 전달하는 기술이 확립되고 나면 다시 개발할 필요가 없다.
mRNA 백신의 또다른 특징은 새로운 기능을 갖도록 서열만 바꾸어 주면 기존의 mRNA를 신약으로 이용할 수 있다는 점이다. 예를 들어, 이번에 mRNA 백신을 개발한 독일의 바이온텍은 원래 mRNA를 이용한 항암치료제를 개발하고 있었다. 이 회사는 2020년 1월에 코로나19의 유전체 서열이 공개되자 mRNA 백신을 개발하기 시작하였고 4월까지 동물실험을 마치고 임상시험을 개시하였으며 12월에는 사용 허가를 받았다. 같은 시간에 미국의 모더나에서도 또 다른 mRNA 백신을 개발하였는데 이 경우에도 1월에 개발에 착수하여 12월에 사용 허가를 받아 냈다. 따라서 mRNA 플랫폼 기술은 기존의 신약과는 달리 새로운 의약품의 연구개발 기간을 획기적으로 줄일 수 있는 장점이 있다.
mRNA 백신 생산 방법
mRNA는 전령 리보핵산(messenger RiboNucleic Acid)의 줄임말로 유전정보를 가진 DNA가 mRNA가 되고 이를 이용하여 단백질이 합성되는 과정에서 DNA와 단백질을 연결해주는 중간체이다. mRNA는 1961년 케임브리지대학의 시드니 브레너 교수가 “단백질 합성을 위한 정보를 유전자에서 리보솜으로 전달하는 불안정한 중간물질”이라는 논문으로 「네이처」에 발표하면서 알려졌다. 제목에서 알 수 있듯이 mRNA는 불안정하다는 특징을 가지고 있으므로 저온 보관을 해야 한다. 또한 불안정한 구조 때문에 mRNA 연구는 DNA와 단백질에 비해서 늦게 발전했다. mRNA는 생화학적으로 시험관 내에서 합성 가능한데, 이를 IVT(In Vitro Transcription)라고 하며 mRNA 백신을 만드는 주요 방법이다. 구체적으로, mRNA 백신을 만들기 위해서는 먼저 박테리아를 이용하여 DNA를 대량으로 생산하고 이를 정제한다. 정제된 DNA와 RNA 중합효소를 이용하여 IVT로 mRNA를 합성하고 정제한다. IVT는 모든 환경을 조절할 수 있는 화학 반응이기 때문에 mRNA 백신은 불순물이 거의 없도록 만드는 것이 가능하다. 따라서 다른 백신에 비하여 부작용의 가능성이 매우 낮다.
mRNA 백신, DNA 백신, 단백질 백신
백신은 여러 종류가 있으며 과거에는 비활성화된 병원균을 이용하였지만, 최근에는 병원균의 표면 단백질을 주로 이용한다. 코로나바이러스의 경우에는 돌기 단백질(spike protein)이 특징이기 때문에 백신 대부분은 이 돌기 단백질을 만들어 준다. 세포 내에서 돌기 단백질을 만들기 위해서는 DNA와 mRNA를 넣어주어야 가능하므로 DNA, mRNA, 단백질 모두가 백신으로 이용되고 있다.

DNA, mRNA, 돌기 단백질을 이용한 백신의 제작 ⓒbiorender.com
DNA 백신은 이미 널리 이용되고 있는데 영국 옥스퍼드대학에서 개발한 아스트라제네카 백신은 대표적인 DNA 백신이다. 최근 미국에서 한국군을 위해서 보내준 얀센 백신, 러시아의 스푸트니크 V, 중국의 시노백도 모두 DNA 백신이다. 국내에서도 코로나19 DNA 백신을 개발하여 임상시험 중에 있으며 최근 제넥신이 임상 2상에 들어갔다. DNA 백신도 플랫폼 기술로 mRNA처럼 서열만 바꾸어 주면 원하는 것을 만들 수 있으므로 빠르게 개발할 수 있는 장점이 있다. 하지만 DNA 백신은 RNA 백신과 달리 핵막을 지나 세포핵에 도달해야 작용을 하므로 화학적인 방법으로는 전달하기가 쉽지 않다. 그래서 보다 효과적인 DNA 전달을 위해서 바이러스를 매개로 이용한다. 현재 대부분의 DNA 백신은 감기를 일으키는 아데노바이러스를 이용하고 있으므로 DNA 백신을 맞으면 감기에 걸린 것과 같은 증상이 나타난다. 이 백신의 약점은 세포핵 내에 들어간 백신 DNA가 인간의 DNA 내로 삽입될 가능성이 걱정할 정도로 크지는 않지만 분명히 존재한다는 점이다.
단백질도 백신으로 이용하고 있다. 미국의 노바백스사에서 단백질 백신을 개발하고 있다. 단백질은 플랫폼 기술이 아니기 때문에 DNA나 mRNA보다 개발 과정이 오래 걸려 2021년 6월 현재 임상시험이 아직 끝나지 않았다. DNA와 단백질도 모두 백신으로 사용되고 있지만 지금 가장 인기 있는 백신은 mRNA 백신이다.
mRNA 백신 개발의 난관과 극복
효능이 뛰어나고 부작용이 적은 mRNA 백신 기술은 왜 2020년이 되어서야 처음으로 사용되기 시작했을까. 백신 개발에서 두 가지의 큰 어려움을 극복하는 데 긴 시간이 걸렸기 때문이다. 첫째는 mRNA를 합성해서 인체에 넣어주었을 때 선천면역(innate immunity) 반응이 일어난다는 것이었다. 인체에는 선천면역과 후천면역 두 가지의 면역 체계가 있는데 우리에게 익숙한 백신을 맞아서 면역이 생기는 현상을 후천면역(adaptive immunity)이라고 한다. 그런데 우리 몸에는 바이러스와 미생물 등 침입자들의 일반적인 특징에 반응하는 선천면역도 존재한다.

mRNA에 의한 선천면역 반응과 이를 회피한 m1Ψ으로 합성한 mRNA의 개발
ⓒ「네이처 리뷰스 드럭 디스커버리」 17(4):261-279, 「ACS 센트럴 사이언스」 7(5): 748-756.
상단의 그림은 외부에서 유래된 mRNA가 엔도솜에 들어 있을 때 선천면역에 관여하는 단백질(TLR3, 7, 8) 등이 이를 인지하고, 그 결과 외부에서 들어온 mRNA를 이용한 단백질 합성을 억제하는 과정을 보여주고 있다. 따라서 실험실에서 일반적인 방법으로 mRNA를 합성해서 세포에 넣어주게 되면 이 mRNA는 단백질 합성을 효과적으로 하지 못해 백신이 되지 못한다.
2005년 펜실베이니아대학의 카탈린 카리코 박사와 드류 와이즈만 교수는 선천면역에 관련된 단백질들이 어떻게 외부에서 유래한 mRNA와 인체에서 생성한 mRNA를 구분할 수 있는지를 밝혀냈다. 상단의 그림에서처럼 일반적인 우라실 염기를 대신해서 화학구조가 조금 다른 m1Ψ을 이용하게 되면 선천면역 반응이 일어나지 않는다는 새로운 사실을 찾아내었다. 이 원리를 이용하여 2008년에는 선천면역 반응을 회피하는 mRNA를 생화학적 방법으로 합성하는 데 성공하면서, 이를 이용하여 원하는 단백질을 인체 내에서 효과적으로 만들어 낼 수 있게 되었다. 이 방법은 현재 코로나19 mRNA 백신을 만드는 핵심기술로 이용되고 있다.
mRNA 백신 전달체 '지질 나노입자'
두 번째 어려움은 불안정한 mRNA를 주사했을 때 손상되지 않고 세포까지 전달시키는 과정에서 mRNA를 보호해 줄 물질이 필요하다는 것이었다. 우리 몸에는 mRNA를 분해하는 효소가 많이 있으므로 이들을 피해 세포까지 가는 게 쉽지 않다. 또한, mRNA는 음이온이 너무 많아 지질이중층으로 된 세포막을 통과하기가 쉽지 않다. 이러한 어려움은 siRNA 전달 방법이 2018년 FDA 허가를 받으면서 가능하게 되었다.
siRNA는 짧은 간섭 RNA(small interfering RNA)라고 하며 세포 내의 특정 유전자의 활동을 억제하기 위해서 개발되었다. siRNA는 1998년 처음 개발되어 2006년 노벨상까지 받으며 국내외에서 활발히 연구하고 있는 주제였지만 최근까지 임상에는 활용하지 못하였다. siRNA를 세포에 전달하는 방법은 캐나다 브리티시 컬럼비아대학의 피터 컬리스 교수 그룹에서 개발된 지질 나노입자(Lipid Nanoparticle, LNP)로 가능하게 되었다. 2018년 LNP로 감싼 siRNA가 FDA 승인을 받으면서 siRNA를 임상에 사용할 수 있게 되었고, 이 기술을 바탕으로 LNP로 감싼 mRNA가 현재의 mRNA 백신으로 발전하게 되었다. siRNA는 mRNA에 비해서 크기가 작고 이중가닥으로 구성되어 더 안정적인 구조이기에 먼저 발전할 수 있었다.
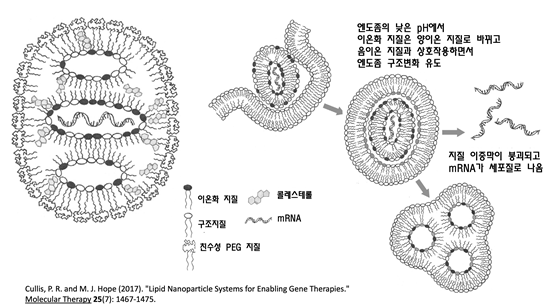
지질 나노입자의 구조와 mRNA가 엔도솜 안에서 세포질로 나오는 작용
ⓒ「몰레큘러 테라피」 25(7):1467-1475
상단의 그림은 LNP의 구성과 mRNA를 세포질로 내보내는 작용을 설명하고 있다. LNP는 이온화 지질, 구조지질, 콜레스테롤, 친수성 PEG 지질 등으로 구성되어 있다. 이 중에서 LNP의 핵심기술이라고 할 수 있는 이온화 지질은 중성 pH에서는 독성이 없는 중성으로 존재하다가 세포에 들어갈 때 엔도솜이 만들어지면서 pH가 낮아지면 양이온 지질로 바뀌게 된다. 이때 엔도솜 내부에 있는 음이온 지질과 짝을 이루면서 엔도솜의 지질이중막 구조를 무너뜨리고, mRNA는 세포질로 탈출하게 되며 이를 이용하여 세포 내에서 단백질을 합성한다.
mRNA 백신은 코로나19를 예방하는 가장 뛰어난 의약품으로 주목을 받고 있다. 동시에 mRNA를 의약품으로써 인체에 적용할 수 있는 새로운 문을 열어 주었다. mRNA는 플랫폼 기술로써 개발 과정이 기존의 다른 의약품에 비해서 짧으므로 신약개발에 혁명적인 변화가 펼쳐질 것으로 기대되고 있다. 또한 이러한 mRNA 플랫폼은 백신뿐 아니라 각종 질병에 대한 해결책을 제시할 것으로 보인다. 더 나아가 인간의 노화 현상을 조절하고 다시 젊어질 수 있도록 세포 수준의 조절이 가능해지는 미래 의학 기술의 초석이 될 것이다.
글 | 조규봉 서강대학교 화학과 교수
서울대학교에서 학부와 석사를 마친 후에 삼성종합기술원 연구원으로 근무했다. 2006년에 미국 위스콘신대학교(UW-Madison)에서 박사학위를 받았고 일리노이대학교(UIUC)에서 박사후연구원으로 근무했다. 2008년부터 서강대학교 화학과 및 바이오융합 교수로 재직하고 있다.
※한국과학기술단체총연합회에서는
과학기술 대중화와 과학문화 확산을 위해
월간 「과학과기술」과 <한국과총 Webzine>을
발행하고 있습니다. 많은 관심과 구독 부탁드립니다.
[출처] [Focus] mRNA 백신의 화학적 원리와 구조|작성자 한국과총
'현대 창조론 연구 자료실 > 창조론 연구를 위한 과학 뉴스' 카테고리의 다른 글
| 알파고 바둑대결 5년..어느덧 일상에 파고든 AI (0) | 2021.08.10 |
|---|---|
| 상상초월 엄청난 금속 매장된 땅이 있다!..세계 경제 '위협'까지? (0) | 2021.08.09 |
| '최초 포착' 블랙홀이 중성자별을 잡아먹는 순간! (0) | 2021.08.03 |
| 폭염에 시베리아 땅속 메탄가스 대량 방출..온난화 가속 우려 (0) | 2021.08.03 |
| 인공지능은 어떻게 탄생했을까? (0) | 2021.08.01 |