2020.07.28 15:43
게티이미지뱅크 제공
나이가 들수록 ‘부익부 빈익빈(富益富 貧益貧)’이라는 말에 점점 더 공감하게 된다. ‘눈덩이 효과’도 비슷한 말이다. 초기 약간의 차이가 시간이 지날수록 점점 더 벌어져 나중에는 다른 세상에 사는 것처럼 보이는 현상을 반복해서 목격했기 때문이다.
예를 들어 잘 나가는 친구의 일터에 놀러 가면 얼마 지나지 않아 마음이 불편해진다. 수시로 전화벨이 울리고 서류를 든 직원이 문을 노크한다. 식당에서도 연신 휴대전화를 들여다보고 통화를 한다. 결국 “바쁜 것 같은데 너무 시간을 뺏았네...”라며 서둘러 자리를 정리한다. 반면 직장에서 한직에 있거나 정리해고된 뒤 친구를 만나면 두세 시간 내내 둘 다 휴대전화를 볼 일이 없다.
과학자도 마찬가지 아닐까. 유명 학술지에 논문을 내 주목을 받은 과학자에게는 똑똑한 학생들이 몰리고 여기저기서 공동연구 제안이 들어온다. 그 결과 좋은 결과가 나와 논문이 또 유명 학술지에 실리면 새로운 연구 프로젝트도 쉽게 딸 수 있다. 인재와 아이디어가 계속해서 들어오고 여기서 좋은 결과가 나와 다시 주목을 받는 식이다. 이런 선순환이 몇 차례 반복되면 그 과학자는 어느 새 해당 분야의 거장이 돼 있다.

2016년 DNA 가닥을 자르지 않고도 GC염기쌍을 AT염기쌍으로 바꾸는 염기편집 기술을 개발한 하버드대 데이비드 리우 교수는 2017년 ‘네이처’ 선정 ‘과학계 화제의 인물’에 뽑히기도 했다. 최근 리우 교수팀은 공동연구를 통해 미토콘드리아 염기편집에 성공해 다시 주목을 받고 있다. 2012년 39세 때 모습이다. 위키피디아 제공
지난주 학술지 ‘네이처’에 실린 한 논문의 교신저자인 미국 하버드대 데이비드 리우 교수를 보며 떠올린 생각이다. 리우 교수는 유전자 편집 분야에서 가장 잘 나가는 과학자로, ‘네이처’ 선정 ‘2017년 과학계 화제의 인물’로 선정되기도 했다. 지난 2016년 리우 교수팀은 염기편집(base editing)이라는 신기술을 개발했는데, 기존 게놈편집 기술과는 달리 DNA이중나선 가닥을 자르지 않고 특정 위치의 GC염기쌍을 AT염기쌍으로 바꿀 수 있어 주목을 받았다.
참고로 현재 널리 쓰이고 있는 3세대 게놈편집 기술인 크리스퍼/캐스9 시스템은 특정 염기서열을 인식해 DNA이중나선을 풀고 자른 뒤 세포 내 복구 시스템이 작동하면서 편집이 일어난다. 유전자 질환 다수는 단일 염기의 돌연변이 때문에 일어나므로 굳이 DNA가닥을 자르지 않아도 되는 염기편집 기술이 널리 쓰일 것이다.
이번에 ‘네이처’에 실린 논문 역시 DNA가닥을 자르지 않고 특정 위치의 GC염기쌍을 AT염기쌍으로 바꿀 수 있는 기술을 소개하고 있다. 그럼에도 4년 전 논문과는 전혀 다른 내용이고 중요도 면에서 어쩌면 더 높게 평가할 수도 있다. 세포 핵의 게놈이 아니라 미토콘드리아 게놈을 대상으로 염기편집에 성공했기 때문이다. ‘네이처’는 이례적으로 이 논문에 대해 관련 분야 전문가의 해설을 붙였을 뿐 아니라 사설과 기사(뉴스)로도 다뤘다.
특이한 효소 발견이 출발점

세포 하나에는 세포호흡을 담당하는 소기관인 미토콘드리아가 수백~수천 개 들어있다. 미토콘드리아 게놈의 돌연변이가 생겨 기능이 부실해지면 다양한 질병으로 나타난다. 크리스퍼/캐스9 시스템은 가이드RNA가 미토콘드리아 막을 통과하지 못하기 때문에 게놈편집에 쓸 수 없다. 위키피디아 제공
2018년 연말 어느 날 리우 교수는 안면이 없는 워싱턴대 미생물학자 조셉 모고스 교수의 이메일을 받았다. 부르콜데리아(학명 Burkholderia cenocepacia)라는 박테리아에서 특이한 효소를 발견했는데 어쩌면 염기편집에 쓰일 수도 있을 것 같으니 검토해봐달라는 내용이었다. 흥미를 느낀 리우 교수는 모고스 교수와 공동연구를 하기에 이르렀고 2년 만에 논문으로 결실을 맺었다.
부르콜데리아의 효소는 DNA이중나선의 시토신(C)을 우라실(U)로 바꾸는 시티딘 디아미네이즈(cytidine deaminase)다. 2016년 리우 교수가 염기편집에 썼던 효소도 시티딘 디아미네이즈였지만 DNA단일가닥에서 작용한다는 점이 다르다. 리우 교수는 이 차이에 주목했고 부르콜데리아의 효소가 미토콘드리아 게놈 편집에 쓰일 수 있음을 깨달았다.
미토콘드리아는 세포의 발전소로 유기분자를 산화시켜 ATP라는 에너지 분자를 만든다. 세포 하나에는 수백~수천 개의 미토콘드리아가 들어있다. 그리고 미토콘드리아는 자체적으로 단백질 13개의 유전자 정보를 담고 있는 작은 게놈을 갖고 있다.
2000년 들어 미토콘드리아가 건강과 수명에 결정적인 역할을 한다는 사실이 점차 분명해지면서 미토콘드리아 게놈에 대한 관심도 높아지고 있다. 그럼에도 핵 게놈과는 달리 크리스퍼/캐스9 같은 편리한 게놈편집 기술을 쓸 수 없다는 게 문제였다. 게놈에서 편집할 위치를 안내하는 가이드RNA가 미토콘드리아 막을 통과하지 못하기 때문이다.
게놈을 파괴할 수는 있지만...

1세대(ZFN) 또는 2세대(TALEN) 기술을 써서 미토콘드리아 게놈편집을 할 수 있지만 표적 염기를 자를 수 있을 뿐 다른 염기로 바꿀 수는 없다는 게 한계였다. 그 결과 게놈에 변이가 있는 미토콘드리아를 솎아내는 데 쓰인다. '셀' 제공
그럼에도 미토콘드리아 게놈편집이 불가능한 건 아니다. 가이드RNA가 필요 없는 1세대(ZFN)와 2세대(TALEN) 게놈편집 기술을 쓰면 되기 때문이다. 이 기술들은 가이드RNA 대신 단백질 자체가 특정 염기서열을 인식하게 구조를 설계한다. 이 과정이 어렵고 비용이 많이 들어 핵 게놈편집에서는 3세대 기술인 크리스퍼/캐스9에 밀렸지만 미토콘드리아에서는 오히려 장점이 됐다.
지난 2013년 2세대 기술로 미토콘드리아 게놈편집에 처음 성공했지만, 표적이 되는 게놈을 파괴할 수 밖에 없다는 한계가 있었다. 미토콘드리아에는 DNA이중나선 가닥이 잘리면 이를 복구하는 시스템이 없기 때문이다. 원형인 게놈이 잘린 채 방치되면 결국 미토콘드리아가 죽는다. 게놈편집이 게놈에 치명적인 돌연변이가 있는 미토콘드리아를 제거하는 ‘삭제’ 용도로만 쓰일 수 있다는 말이다.
참고로 한 세포 안에 있는 미토콘드리아 수백~수천 개 각각의 게놈은 동일하지 않은 경우가 많다. 이를 이형세포질성(heteroplasmy)라고 부른다. 미토콘드리아 질환의 증상이 개인에 따라 미미하거나 심각한 이유도 치명적인 돌연변이를 지닌 미토콘드리아의 비율이 다르기 때문이다. 이 기술을 쓰면 치명적인 변이를 지닌 미토콘드리아를 선별적으로 없애 정상 미토콘드리아의 비율을 높일 수 있다. 그러나 변이를 지닌 미토콘드리아가 절대다수일 경우에는 쓸 수 없다.
교묘하게 설계된 시스템
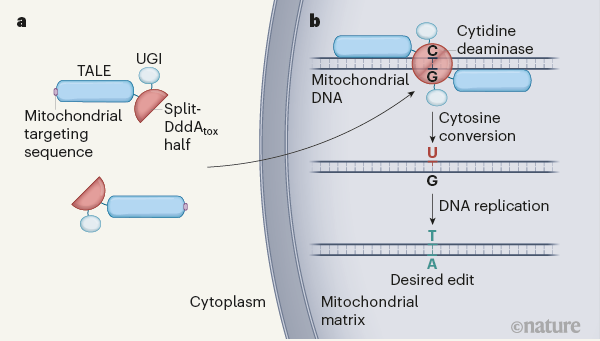
최근 미국 워싱턴대와 하버드대 공동연구자들은 부르콜데리아 박테리아에서 발견한, DNA이중나선의 C를 U로 바꾸는 효소(DddA)를 2세대 게놈편집 단백질(TALE)에 결합해 미토콘드리아 게놈의 특정 위치에서 C를 T로 바꾸는 데 성공했다. DdCBE로 불리는 이 시스템은 미토콘드리아 질병을 이해하고 치료제를 개발하는 데 큰 도움이 될 전망이다. 네이처 제공
미토콘드리아 게놈의 특정 염기서열에서 C를 T로 바꾸는 시스템은 꽤 복잡하다. 의도하지 않은 결과가 나오지 않아야 하기 때문이다. 먼저 부르콜데리아의 시티딘 디아미네이즈(이하 DddA)가 게놈의 아무데서나 C를 T로 바꾸지 못하게 유전자를 반으로 쪼개 각각 반쪽의 단백질을 만들게 했다. 이 둘이 미토콘드리아의 DNA 가닥 주위에서 하나로 합쳐질 때만 효소로 작용해 C를 T로 바꿀 수 있다.
다음으로 2세대 기술에서는 게놈의 특정 염기서열을 인식해 달라붙기만 하는 TALE를 두 개 만들어 각각에 DddA 조각을 붙였다. 끝으로 여기에 UGI라는, 우라실(U)을 다시 C로 바꾸는 효소를 억제하는 단백질을 붙였다. U는 DNA를 이루는 염기가 아니라서, 미토콘드리아에는 게놈의 DNA에 U가 있을 경우 C로 바꾸는 효소가 있기 때문이다.
TALE와 DddA 반쪽, UGI로 구성된 복합체 한 쌍으로 이뤄진 시스템을 연구자들은 ‘DddA 유래 시토신 염기편집기(DdCBE)’라고 명명했다. 미코콘드리아 게놈의 여러 돌연변이 자리를 대상으로 DdCBE의 성능을 시험한 결과 C를 T로 바꾸는 효율이 낮게는 5%에서 높게는 50%까지 나왔다.
연구자들은 C를 T로 바꾸는 염기편집으로 미토콘드리아의 유해한 돌연변이의 절반 정도를 고칠 수 있다고 추측했다. 다만 미토콘드리아 게놈편집은 초기 배아 단계에서 이뤄져야 하므로 실제 임상에 적용되려면 갈 길이 멀다.
연구자들은 이 기술이 미토콘드리아 질병의 동물 모델을 만드는데 먼저 쓰일 것으로 예상했다. 인간의 미토콘드리아 질병을 일으키는 특정 변이를 염기편집으로 동물 미토콘드리아의 해당 위치에 재현하면 이로 인해 유발되는 질병을 이해하고 치료제를 개발하는 데 큰 도움이 될 것이기 때문이다.
리우 교수는 안면이 없는 모고스 교수가 알려준 효소 덕분에 이번에 놀라운 연구결과를 얻을 수 있었다. 물론 모고스 교수 역시 리우 교수에게 이메일을 보내지 않았다면 자신이 찾은 효소로 이런 환상적인 결과물을 만들어낼 수는 없었을 것이다. 두 사람은 이번 논문의 공동교신저자로 이름을 올렸다. 이런 걸 두고 윈윈 효과라고 하는 게 아닐까.
※필자소개
강석기 LG생활건강연구소에서 연구원으로 일했다. 2000년부터 2012년까지 동아사이언스에서 기자로 일했다. 2012년 9월부터 프리랜서 작가로 활동하고 있다. 직접 쓴 책으로 《강석기의 과학카페(1~8권)》,《생명과학의 기원을 찾아서》가 있다. 번역서로는 《반물질》, 《가슴이야기》, 《프루프: 술의 과학》을 썼다.
- 강석기 과학 칼럼니스트kangsukki@gmail.com
'현대 창조론 연구 자료실 > 창조론 연구를 위한 과학 뉴스' 카테고리의 다른 글
| '핵융합' 실증할 국제실험로 조립 착수…첫 부품은 한국産 (0) | 2020.07.29 |
|---|---|
| '으르렁'대는 미국·중국도 손잡는 초대형R&D 프로젝트 ITER란 무엇인가 (0) | 2020.07.29 |
| 코로나19 바이러스, 미끼로 잡는다 (0) | 2020.07.28 |
| 원폭투하 75년 생존한 피폭자들이 남긴 의학적 유산 (0) | 2020.07.28 |
| 일론 머스크가 만든 '인공지능' 인류 위협할까 (0) | 2020.07.28 |